Grenzschichten initiieren die Entwicklung neuer Meristeme in Pflanzen
Forschungsbericht (importiert) 2016 - MPI für Pflanzenzüchtungsforschung
Gewebegrenzen in mehrzelligen Organismen
In pflanzlichen und tierischen Organismen sind Zellgruppen mit unterschiedlichen Funktionen durch Grenzschichten voneinander getrennt. Diese Trennung ermöglicht die Etablierung unterschiedlicher Gewebe mit spezifischen Identitäten und charakteristischen Genaktivitätsmustern [1, 2]. Im Gegensatz zu Tieren, wo die Entstehung neuer Organe auf die Embryogenese beschränkt ist, sind Pflanzen zeitlebens in der Lage, neue Organe zu bilden und daher ist der Aufbau von Grenzschichten von großer Bedeutung für die gesamte Entwicklung einer Pflanze. Bei zweikeimblättrigen Pflanzen wird früh in der Entwicklung die Grenzschicht zwischen den beiden Keimblättern (Kotyledonen) etabliert. Ein Fehlen dieser Schicht führt zur Fusion der Keimblätter. Im Grenzbereich zwischen den Keimblättern entsteht das sogenannte Sprossapikalmeristem, das eine Gruppe teilungsfähiger Stammzellen enthält und den Ausgangspunkt für das gesamte Wachstum im oberirdischen Teil einer Pflanze darstellt (Abb. 1). Bei der Entwicklung der Blätter aus dem Sprossmeristem spielen Grenzschichten wieder eine wichtige Rolle, da sie die an der Peripherie des Sprossmeristems entstehenden Blattanlagen (Blattprimordien) vom Rest des Sprossmeristems abgrenzen. In Pflanzen mit gefiederten Blättern, wie der Tomate, sind Blattfiedern voneinander und von der Blattrachis durch eine Grenzschicht getrennt. Manche Grenzschichten können später zu Abszissionzonen differenzieren und sind somit auch für den Fall von reifen Früchten und Blättern zuständig [3].

Wie entstehen Grenzschichten in Pflanzen?
Transkriptionsregulatoren, Phytohormone und mechanische Kräfte interagieren, um funktionale Grenzen zu etablieren und aufrechtzuerhalten [3]. Im Vergleich zu den Nachbargeweben zeigen Zellen in den Grenzschichten zwischen Apikalmeristem und Blattprimordien sowie in gefiederten Blättern reduzierte Zellteilungsaktivität und verringertes Zellstreckungswachstum. Diese Charakteristik wird unter anderem auf eine starke lokale mechanische Belastung zurückgeführt, die Zellexpansion und Zellform stark beeinflusst [4]. Die Verteilung pflanzlicher Hormone wie Auxin und Branssinosteroiden zwischen Sprossapikalmeristem, Grenzschicht und Blattanlage weist eine subtile Regulation auf: Geringere Konzentrationen an Auxin und Brassinosteroiden in der Grenzzone sind Voraussetzung für eine Unterdrückung der Zellteilungaktivität und somit für den Aufbau und die Aufrechterhaltung der Grenzschichten [3, 5]. In den Modellpflanzen Arabidopsis und Tomate konnte gezeigt werden, dass sowohl Auxin als auch Brassinosteroide ihre Funktion teilweise über eine Repression der Transkriptionfaktoren CUP-SHAPED COTYLEDON1 (CUC1), CUC2 und CUC3 beziehungsweise deren Ortholog Goblet (Gob) ausüben [3]. In den Grenzzonen führt die Reduktion der Auxin- und Brassinosteroid-Konzentration zu einer De-Repression der CUC/Gob-Gene und somit zu einer Unterdrückung von Zellteilungen und Wachstum. Mutationen in CUC/Gob-Genen bedingen eine Fusion der Keimblätter und einen Funktionsverlust des Apikalmeristems. Es konnten viele weitere Transkriptionsfaktoren identifiziert werden, wie zum Beispiel LATERAL ORGAN FUSION1 (LOF1), LOF2, JAGGED LATERAL ORGANS (JLO) und LATERAL ORGAN BOUNDARIES (LOB), die wichtige Rollen in den Grenzschichten innehaben [4].
Grenzschichten fördern die Entstehung neuer Meristeme

Neben dem Sprossapikalmeristem initiieren Pflanzen sekundäre Meristeme in den Achseln von Blättern (Achselmeristeme; Abb. 2a, b). Achselmeristeme entwickeln sich weiter zu Knospen (Achselknospen), die entweder zu Seitentrieben auswachsen oder zunächst einmal ruhend bleiben. Variationen in der Anzahl der angelegten Achselmeristeme sowie im Grad des Auswachsens der Achselknospen tragen wesentlich zur großen Vielfalt in der Architektur verschiedener Pflanzenarten bei. Untersuchungen zur Entstehung von Seitentrieben bei Arabidopsis und Tomate zeigten, dass Achselmeristeme in den Grenzschichten zwischen dem Sprossmeristem und den sich entwickelnden Blattanlagen als Vorwölbungen von vorwiegend undifferenzierten Zellen mit meristematischen Merkmalen entstehen [6, 7]. Diese Befunde bringen Grenzschichten mit der Anlage von Gründerzellgruppen, die die Fähigkeit besitzen, sich zu neuen Meristemen zu entwickeln, in Zusammenhang. Weiterhin zeigen die Grenzschichten in gefiederten Tomatenblättern ein sehr ähnliches Potential, indem sie als Ausgangspunkt für die Anlage neuer Blattfiedern, aber auch unter bestimmten Bedienungen zur Bildung sogenannter ektopischer Meristeme dienen (Abb. 2c). Diese Meristeme, die später zu ektopischen Trieben auswachsen, entstehen interessanterweise nur an den distalen Verbindungsstellen von Blattfiederstängeln und Rachis [7]. Zusammengenommen zeigen diese Untersuchungen, dass Grenzschichten in pflanzlichen Organen nicht nur als physische Barriere zwischen Geweben mit unterschiedlichen Funktionen, sondern auch als Ausgangspunkt für die Entwicklung des Verzweigungsmusters von Pflanzen betrachtet werden sollten.
Ähnliche Gen-Module regulieren die Bildung von Seitentrieben und Blattfiedern
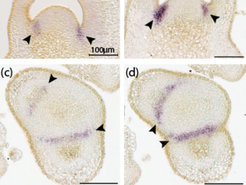
Aus Sicht der Pflanzenzüchtung ist bei manchen Nutzpflanzen, wie zum Beispiel der Tomate, eine Reduktion in der Sprossverzweigung erwünscht, da Seitentriebe den Ertrag am Haupttrieb reduzieren und daher im Ertragsanbau manuell entfernt werden. Aus diesem Grund sind Mutanten, die kaum Seitentriebe bilden, wie beispielsweise die lateral suppressor (ls)-Mutante, kommerziell interessant. Das Ls-Gen hat ein spezifisches Expressionsmuster und ist in den Grenzschichten der Achseln von Blattprimordien aktiv (Abb. 3a, c), wobei die Expression von Ls mit der Etablierung von Gründerzellpopulationen korreliert zu sein scheint [7]. Diese Zellgruppen, die Ausgangspunkt zur Anlage von Achselmeristemen sind, findet man im Wildtyp, aber nicht in ls-Mutanten, die kein funktionsfähiges Ls-Protein bilden. Somit fördert das Ls-Gen die Etablierung und Aufrechterhaltung undifferenzierter Zellgruppen und folglich auch die Fähigkeit, ständig neue Meristeme zu bilden.
Erstaunlicherweise zeigen gob- und ls-Mutanten einen ähnlichen Spross-Phänotyp, der durch die weitgehende Abwesenheit von Achseltrieben gekennzeichnet ist [8]. Zudem bilden beide Mutanten, im Gegensatz zum Wildtyp, keine ektopischen Meristeme auf den Blättern [7]. Diese Beobachtungen deuten an, dass Gob, zusätzlich zu seiner Rolle in der Grenzschicht zwischen den Keimblättern, in anderen Grenzschichten aktiv ist und zusammen mit Ls die Bildung von neuen Meristemen reguliert. Der Spross-Phänotyp von gob- und ls-Mutanten passt gut zu den Expressionsmustern beider Gene, da Gob-mRNA genauso wie ls-mRNA in den Grenzschichten zwischen Sprossmeristem und Blättern nachgewiesen wurde (Abb. 3b, d). Darüber hinaus akkumuliert Gob- und Ls-mRNA in den Grenzzonen zwischen den Blattfiedern (Abb. 3a, b, e, f). Die reduzierte Ls-Expression in der gob-Mutante lässt vermuten, dass beide Gene im gleichen Signalweg aktiv sind und dass GOB LS reguliert.

Im Gegensatz zur ls-Mutante haben gob-Pflanzen vereinfachte Blätter, die keine Fiedern zweiter Ordnung, keine Blattlappung und keinen gezackten Blattrand aufweisen [8]. Dieser Blattphänotyp ähnelt dem der trifoliate (tf)-Mutante, die neben den weniger gefiederten Blättern ebenfalls eine geringere Sprossverzweigung als der Wildtyp aufweist. Tf kodiert einen MYB-Transkriptionsfaktor, der in Blattachseln und am Blattrand akkumuliert und undifferenzierte Zellgruppen aufrechterhält [9]. Obwohl Sprossverzweigung und Blattentwicklung sehr verschiedene Entwicklungsprozesse darstellen, zeigen die Expressionsmuster der Gene Gob und Tf sowie die Phänotypen der entsprechenden Verlustmutanten, dass beide Prozesse von gleichen Genen beziehungsweise Gen-Modulen reguliert werden, was die Ähnlichkeit von unterschiedlichen Grenzschichten noch einmal betont. Diese Vergleichbarkeit wurde nochmals untermauert durch die Analyse von zwei weiteren Tomatenmutanten: potato leaf und blind. Während die potato leaf-Mutante vereinfachte Blätter, aber eine Wildtyp-ähnliche Verzweigung aufweist, bildet die blind-Mutante fast keine Seitentriebe, aber normal gefiederte Blätter. Es konnte gezeigt werden, dass zwei mutierte Transkriptionsfaktoren die Ursache für die phänotypischen Veränderungen darstellen. Sowohl das Potato leaf-Gen (C) als auch das Blind-Gen (Bl) kodieren R2R3 MYB-Regulatoren, die evolutionär von einem gemeinsamen Vorfahren abstammen, aber in verschiedenen Grenzschichten aktiv sind [9, 10]. C wird in den Grenzschichten der Blattfiedern exprimiert, während das Bl-Protein in der Grenzzone zu den Blattanlagen nachweisbar ist. Interessanterweise hat die Doppelmutante gob c langgestreckte, vollständig ungefiederte Blätter, die kaum Ähnlichkeit zu normalen Tomatenblätter zeigen (Abb. 4). Diese extreme Reduktion der Blattfiederung, die deutlich stärker ist als bei den Einzelmutanten, weist daraufhin, dass Gob und C in unterschiedlichen Signalwegen aktiv sind [8].
Zusammengefasst spielen Grenzschichten eine wichtige Rolle während der Entwicklung der Pflanzenarchitektur, indem sie einerseits die Entwicklung funktionaler Organe ermöglichen und andererseits Ausgangspunkte für die Anlage primärer und sekundärer Meristeme darstellen. Außerdem verbinden Grenzzonen zwei vorher als unterschiedlich angesehenen Prozesse, nämlich die Sprossverzweigung und die Fiederblattentwicklung. Somit könnte die Aufklärung von Mechanismen im ersten Prozess auch ein besseres Verständnis des zweiten maßgeblich fördern.



