Rationales Design von Enzymen mit neuartigen Eigenschaften
Forschungsbericht (importiert) 2007 - MPI für Pflanzenzüchtungsforschung
Sekundäre Pflanzeninhaltsstoffe dienen der Anpassung an eine variable Umwelt
Pflanzen sind in ihrer Umwelt fest verwurzelt und daher nicht in der Lage, Stress oder harschen Umweltbedingungen auszuweichen. Um sich den wechselnden Lebensbedingungen an einem Standort anzupassen, haben Pflanzen im Verlauf der Evolution durch plastische Anpassung ihres Metabolismus auf diese Einflüsse chemische und biochemische Schutzmechanismen entwickelt, die mechanische Widerstandsfähigkeit verleihen (Lignin, Verholzung), Wasserverlust verhindern (Wachs- und Korkschichten), schädliche UV-Strahlen abhalten (Farbstoffe, Schutzpigmente) und vor Befall durch Mikroorganismen und Insekten schützen (Antibiotika, Inhibitoren) [1]. Als Folge dieses Prozesses sind Pflanzen in der Lage, eine außerordentliche Vielfalt an chemischen Verbindungen zu synthetisieren (über 100000 Substanzen sind bisher identifiziert worden), die als Sekundärmetabolite bezeichnet werden und in der Vergangenheit häufig nur als Abfallprodukte des Primärstoffwechsels angesehen wurden. Inzwischen ist für viele Substanzklassen aber nachgewiesen worden, dass sie wichtige biologische Funktionen erfüllen [2]. Die meisten Substanzen werden über wenige Stoffwechselwege produziert und können somit großen Substanzklassen zugeordnet werden, beispielsweise Alkaloiden, Isoprenoiden, Phenylpropanoiden oder Glucosinolaten.
Die außerordentliche Strukturvielfalt entsteht durch Variation der Ausgangsverbindung und der enzymatischen Modifikation der Endprodukte durch Hydroxylierung, Methylierung, Oxidation oder Verknüpfung mit Zuckerresten (Glykosylierung) [3]. Verwandte Pflanzenfamilien synthetisieren häufig gleichartige Substanzen - Leguminosen stellen Isoflavonoide her, Solanaceaen synthetisieren Sesquiterpene -, was auch als taxonomisches Merkmal dienen kann, während andere Substanzklassen, wie Phenylpropanoide, in allen Pflanzenfamilien vertreten sind [4].
Vom Phenylpropanoidstoffwechsel leiten sich viele wichtige Substanzen ab
Verbindungen, die als Abwehrstoffe gegen biotischen und abiotischen Stress wirken und damit eine große Bedeutung bei der natürlichen Resistenz von Pflanzen gegenüber Mikroorganismen (Bakterien, Pilze) oder Verwundung (Insektenfraß) haben, finden sich in allen Substanzklassen [2]. Der in Pflanzen ubiquitäre Phenylpropanoidstoffwechsel nimmt dabei eine besondere Stellung ein, weil einerseits Massenprodukte wie Lignin oder Kork über diesen Weg gebildet werden, die als Holzkomponenten für die Entwicklung und Stabilität von Pflanzen wichtig sind und neben Cellulose die häufigsten Biopolymere der Erde darstellen, andererseits leitet sich eine enorme Vielfalt von Verbindungen aus dem Phenylpropanoidstoffwechsel ab, die zusätzliche biologische Funktionen als Antibiotika, Antioxidantien, Blüten- und Fruchtfarbstoffe oder Signalstoffe erfüllen. Alle Phenylpropanoide werden aus Phenylalanin synthetisiert, das durch die Wirkung von drei Enzymen in einen aktivierten Zimtsäure-CoA-Ester umgewandelt wird, der als Ausgangsverbindung für die nachfolgenden, komplexen Stoffwechselwege dient (Abb. 1).
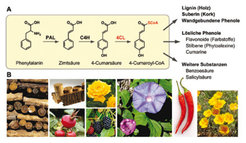
Das letzte Enzym dieser Reaktionskette, 4-Cumarat:CoA-Ligase (4CL), nimmt eine besondere Stellung ein, weil es am Verzweigungspunkt zu den nachgeordneten Stoffwechselwegen liegt und vermutlich an der Steuerung des Stoffflusses in die unterschiedlichen Wege beteiligt ist. Darüber hinaus zeichnen sich alle bisher untersuchten 4CL-Enzyme dadurch aus, dass sie ein breites Substratspektrum verwerten und neben 4-Cumarsäure (4-Hydroxyzimtsäure) auch andere, natürlich vorkommende Zimtsäurederivate umsetzen, was zu der bereits erwähnten Produktvielfalt beiträgt. Die Frage, durch welchen Mechanismus Substrate ausgewählt, in bestimmte Stoffwechselwege kanalisiert und damit in ein entsprechendes Produktspektrum umgewandelt werden, ist weitgehend ungeklärt.
Isoenzyme erfüllen spezifische Aufgaben im Pflanzenmetablismus
In der Modellpflanze Arabidopsis thaliana sind 4-Cumarat:CoA-Ligasen (4CLs) durch vier Gene kodiert, die sich in ihren Expressionsmustern unterscheiden. In Kombination mit den unterschiedlichen enzymatischen und regulatorischen Eigenschaften der kodierten Enzyme werden dadurch unterschiedliche Aufgaben erfüllt, beispielsweise die Biosynthese von Lignin oder Flavonoiden in speziellen Zelltypen oder Organen [5]. Das herausragende Merkmal des Isoenzyms At4CL2 ist, dass Ferulasäure (3-Methoxy-4-hydroxyzimtsäure) im Gegensatz zu anderen Zimtsäurederivaten nicht umgesetzt wird [6]. Diese natürliche Verlustmutante diente einer Forschergruppe des Max-Planck-Instituts für Züchtungsforschung als Ausgangsmaterial, den molekularen Mechanismus der Substratselektion in dieser Enzymklasse aufzuklären. Als Hilfsmittel wurde in Zusammenarbeit mit einer Arbeitsgruppe der Universität Köln zunächst ein dreidimensionales Strukturmodell des Enzyms erstellt (Abb. 2).
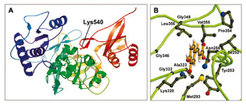
In dieses Modell ließen sich die gut umgesetzten Substrate 4-Cumarsäure und Kaffeesäure (3,4-Dihydroxyzimtsäure) leicht einpassen, während sich für die größere Ferulasäure ein sterischer Konflikt mit zwei Aminosäureresten (Leucin-320 und Methionin-293) ergab, die im 3-D-Modell benachbart sind [7]. Der zielgerichtete Austausch dieser großen Aminosäuren gegen kleinere, wie sie in anderen 4CLs vorliegen, führte zu einer Enzymvariante, die aufgrund der vergrößerten Substratbindungstasche erwartungsgemäß Ferulasäure umsetzte (Abb. 3). Dieses „Erfolgserlebnis“ hat nicht nur das Strukturmodell bestätigt, sondern auch die Kreativität der Forscher angespornt, nach weiteren Möglichkeiten zu suchen, um das Substratspektrum des Enzyms gezielt zu erweitern. Sinapinsäure (3,5-Dimethoxy-4-hydroxyzimtsäure) wurde als nächste Herausforderung gewählt, da diese natürlich vorkommende Substanz von At4CL2 gleichfalls nicht umgesetzt wird. Dem Strukturmodell entsprechend, konnte die Substratbindungstasche im vorhergesagten Bereich vergrößert werden, was in diesem Fall durch die gezielte Deletion einer Aminosäure erreicht wurde und was zu einer Enzymvariante führte, die Sinapinsäure umsetzte.
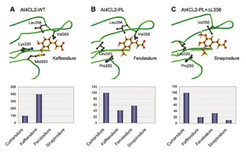
In weiteren Variationen wurde auch die Umsatzrate für die unpolare Zimtsäure gezielt verbessert, indem ein Enzym mit einer aus hydrophoben Aminosäuren aufgebauten Substratbindungstasche hergestellt wurde [7].
Die nächsten Herausforderungen: Neue Möglichkeiten für die Grundlagenforschung und gentechnologische Anwendungen
Welche Schlussfolgerungen und praktischen Anwendungen ergeben sich aus den erzielten Ergebnissen? Zum einen ist da selbstverständlich der rein erkenntnisgewinnende Wert zu nennen, nämlich die detailgetreue Struktur eines Enzyms - der kleinsten biologisch aktiven Einheit - zu erforschen. Weiterführend stellt sich die Frage, ob es möglich ist, die Eigenschaften und Substrate von anderen, bisher nicht untersuchten Enzymen durch solche Ergebnisse vorherzusagen. Dass dies nicht nur eine Annahme, sondern praktische Notwendigkeit ist, ergibt sich aus den vollständig sequenzierten Genomen, die inzwischen für viele Organismen vorliegen und die zahlreiche neue Proteine zu Tage fördern, denen noch eine Funktion zugeordnet werden muss [7, 8]. Diesbezüglich ist mit der Untersuchung von 4CL-ähnlichen Proteinen aus Arabidopsis thaliana zumindest ein Teilerfolg erzielt worden: Für zwei Proteine, deren Substratbindungstasche aus hydrophoben Aminosäuren aufgebaut ist, konnte bestätigt werden, dass sie hydrophobe Substrate, Fettsäuren und Fettsäurederivate (Jasmonsäuren) umsetzen [9, 10].
Zum anderen ist mit den neu geschaffenen Enzymen aber auch die Werkzeugkiste der Forscher um ein weiteres Element bereichert worden, das erlauben sollte, mittels Gentechnik Veränderungen an Pflanzen vorzunehmen. Holzqualität (Hartholz oder Weichholz) ist unter anderem davon abhängig, welche Moleküle von der Pflanze für die Synthese von Lignin verwendet werden, und ebenso werden Blütenfarbe oder andere Pflanzeninhaltsstoffe verändert, wenn modifizierte Ausgangsverbindungen in Stoffwechselwege einfließen.
Dementprechend konzentrieren sich die gegenwärtigen Forschungsaktivitäten auf die Frage, welche Eigenschaften sich in Pflanzen verändern, wenn Enzyme mit neuartigen Eigenschaften durch gezielt steuerbare Promotoren (Genregulatoren) in unterschiedlichen Geweben, Zelltypen oder Entwicklungsstufen synthetisiert werden. Die Auswirkungen solcher gentechnologischen Veränderungen auf die physiologischen und biochemischen Eigenschaften der Pflanzen vorauszusagen ist gegenwärtig nicht möglich. Da die erwähnten Stoffwechselwege und Produkte aber von großer Bedeutung für die Eigenschaften von Pflanzen sind, ist eine spätere Anwendung der gewonnenen Erkenntnisse zur Verbesserung von Nutzpflanzen nicht unrealistisch.


